Secuelas de infección respiratoria por adenovirus: hiperclaridad pulmonar unilateral
El síndrome de Swyer-James-MacLeod es una rara complicación de las infecciones del tracto respiratorio inferior que ocurren en la infancia temprana. Comunicamos dos casos de hiperclaridad pulmonar unilateral en radiografía de tórax y disminución de la vascularización pulmonar en la tomografía axial computarizada torácica. Ambos casos son secundarios a infección por adenovirus. Otras pruebas diagnósticas más agresivas, como la gammagrafía pulmonar, la fibrobroncoscopia y la biopsia pulmonar no son necesarias.
Estudio clínico epidemiológico de las neumonías por «Mycoplasma» en un hospital general de Barcelona
Introducción: Mycoplasma pneumoniae es una de las causas más frecuentes de neumonía en la infancia.
Objetivos: Estudiar los casos de neumonía por M. pneumoniae en un hospital de Barcelona en menores de 15 años, para conocer las características epidemiológicas, clínicas, radiológicas y analíticas, así como determinar si hay diferencias entre menores y mayores de 5 años y en casos de coinfección.
Material y métodos: Se realizó un estudio retrospectivo, revisando las historias clínicas de los menores de 15 años que entre los años 2000 y 2006 fueron atendidos en el Hospital del Mar de Barcelona y cuya IgM para Mycoplasma fue positiva. Posteriormente se realizó un análisis estadístico mediante el programa SPSS.
Resultados: Se diagnosticaron 63 neumonías por Mycoplasma, 35 en niñas y 28 en niños. La media de edad fue de 5,9 años, y el 46% eran menores de 5 años. Hubo un mayor número de casos durante los años 2002 y 2004, sin observar ningún predominio estacional. Las manifestaciones clínicas más frecuentes fueron fiebre (n= 57) y tos (n= 53), además de faringitis o vómitos; la gran mayoría de los casos presentaban un buen estado general. La auscultación pulmonar fue patológica en 57 casos, predominando la unilateralidad y los crepitantes. La alteración radiológica estuvo presente en 59 casos, mayoritariamente unilateral. Los resultados analíticos no presentaron alteraciones significativas. Se pautó tratamiento de forma empírica con penicilina o macrólidos antes de conocer la etiología. Se encontraron 16 coinfecciones con adenovirus, 6 con Chlamydia pneumoniae y uno con enterovirus.
Conclusiones: Mycoplasma debe considerarse como un agente causal de neumonías en la infancia. Destacan la dificultad del diagnóstico diferencial con otras neumonías, la similitud clínica entre mayores y menores de 5 años y el elevado porcentaje de coinfección.
Enterocolitis necrosante asociada a infección por rotavirus
Sr. Director:
El rotavirus pertenece a la familia Reoviridae. Es un virus ARN de doble cadena de 100 nanómetros de diámetro, con simetría icosaédrica y compuesto por tres capas. Carece de envoltura y por microscopia electrónica presenta un aspecto de rueda dentada (de ahí su nombre).
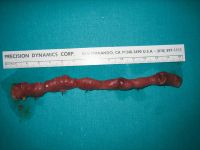 Presentamos el caso de un recién nacido pretérmino que presentó un episodio de enterocolitis necrosante (ECN) asociada a una infección por dicho virus. Se trata de una recién nacida de 30 semanas de gestación y bajo peso para la edad gestacional (820 g) tras una cesárea por preeclampsia materna. No precisó maniobras de reanimación y el test de Apgar fue de 9/10. A las pocas horas de vida presentó una insuficiencia respiratoria. La radiografía de tórax era compatible con una enfermedad de membrana hialina de grado II, por lo que se le administró una dosis de surfactante y se le colocó CPAP nasal, que precisó durante una semana una FiO2 máxima del 30%. Durante las primeras semanas de vida recibió dos ciclos de cefotaxima y vancomicina por sospecha clínica y analítica de sepsis. Se logró introducir la nutrición enteral a los 8 días, con buena tolerancia y aumento progresivo de los aportes. Al cabo de un mes, la paciente toleraba 175 mL/kg/día de fórmula para prematuros.
Presentamos el caso de un recién nacido pretérmino que presentó un episodio de enterocolitis necrosante (ECN) asociada a una infección por dicho virus. Se trata de una recién nacida de 30 semanas de gestación y bajo peso para la edad gestacional (820 g) tras una cesárea por preeclampsia materna. No precisó maniobras de reanimación y el test de Apgar fue de 9/10. A las pocas horas de vida presentó una insuficiencia respiratoria. La radiografía de tórax era compatible con una enfermedad de membrana hialina de grado II, por lo que se le administró una dosis de surfactante y se le colocó CPAP nasal, que precisó durante una semana una FiO2 máxima del 30%. Durante las primeras semanas de vida recibió dos ciclos de cefotaxima y vancomicina por sospecha clínica y analítica de sepsis. Se logró introducir la nutrición enteral a los 8 días, con buena tolerancia y aumento progresivo de los aportes. Al cabo de un mes, la paciente toleraba 175 mL/kg/día de fórmula para prematuros.
A los 33 días de vida presentó deposiciones hemorrágicas, por lo que se inició tratamiento antibiótico para ECN con amoxicilina/clavulánico, gentamicina y metronidazol, previa recogida de coprocultivo. Se le prescribió dieta absoluta. El abdomen era blando, depresible y no presentaba distensión. La radiografía de abdomen mostraba asas distendidas sin signos de ECN. Al cabo de 72 horas comenzó un claro empeoramiento clínico, con distensión abdominal que tuvo una repercusión respiratoria, por lo que la paciente precisó una elevada asistencia ventilatoria. El cuadro se acompañaba de coagulopatía (índice internacional normalizado de 2,01 y actividad de protrombina del 31%) y anemia (hematocrito del 25%). La radiografía simple de abdomen mostraba un íleo paralítico sin signos de perforación, y la ecografía un líquido libre peritoneal. La paciente fue intervenida quirúrgicamente, encontrándose un segmento de intestino delgado de 15 cm, con varias placas necróticas; se realizó una resección del segmento afectado y una anastomosis terminoterminal.
En las tres muestras de heces recogidas se investigó el crecimiento de virus, bacterias y parásitos, y se detectó en todos ellos un crecimiento de rotavirus.
La ECN es una de las patologías potencialmente más graves en las unidades neonatales, que afecta sobre todo a los recién nacidos de muy bajo peso, de menor edad gestacional, con valores bajos de Apgar y con complicaciones perinatales. Es un síndrome clínico por necrosis isquémica del intestino, de etiología multifactorial, tanto con factores infecciosos como no infecciosos. Los organismos predominantes incluyen enterobacterias (Escherichia coli, Klebsiella pneumoniae), Clostridium, patógenos entéricos (Salmonella, Coxsackie, coronavirus, rotavirus) y patógenos potenciales como Bacteroides fragilis1,2.
El rotavirus es el agente etiológico más común en todo el mundo de diarrea en la edad pediátrica, tanto en la comunidad como en el ámbito hospitalario3. En el periodo neonatal se han descrito casos de ECN asociada a infección por rotavirus4,5, e incluso varios casos simultáneos en el contexto de una epidemia de gastroenteritis por rotavirus en una unidad neonatal6; todos ellos en los primeros días de vida.
La ECN es una entidad poco frecuente fuera de las dos primeras semanas de vida7. La paciente presenta factores de riesgo para desarrollar una ECN, como prematuridad, bajo peso, enfermedad de membrana hialina, sospecha clínica de sepsis o cateterización de la vena umbilical. Por el contrario, el hecho de haber tolerado la nutrición enteral exclusiva y que el cuadro se presentara a los 33 días de vida hacen pensar que se trata de un caso atípico de ECN, cuya explicación puede encontrarse en la infección por rotavirus.
Hay que considerar la realización de pruebas diagnósticas virales (incluido el rotavirus) en todo neonato con ECN8. Se deben tomar medidas de asepsia estrictas cuando se aísla rotavirus en una unidad neonatal de cuidados intensivos, por la gravedad que puede conllevar su colonización en recién nacidos de muy bajo peso.
Bibliografía
- Brook I. Microbiology and management of neonatal necrotizing enterocolitis. Am J Perinatol. 2008.
- Boccia D, Stolfi I, Lana S, Moro ML. Nosocomial necrotising enterocolitis outbreaks: epidemiology and control measures. Eur J Pediatr. 2001; 160(6): 385-391.
- Smith MJ, Clark HF, Lawley D, Bell LM, Hodinka RL, DiStefano DJ, et al. The clinical and molecular epidemiology of community- and healthcare-acquired rotavirus gastroenteritis. Pediatr Infect Dis J. 2008; 27(1): 54-58.
- Dani C, Trevisanuto D, Cantarutti F, Zanardo V. A case of neonatal necrotizing enterocolitis due to rotavirus. Pediatr Med Chir. 1994;16(2): 185-186.
- Sharma R, Garrison RD, Tepas JJ 3rd, Mollitt DL, Pieper P, Hudak ML, et al. Rotavirus-associated necrotizing enterocolitis: an insight into a potentially preventable disease? J Pediatr Surg. 2004; 39(3):453-457.
- Goma Brufau AR, Vega Romero M, Martínez Ubieto P, Marco JJ, Salcedo Avizanda S, Peguero Monforte G, et al. Epidemic outbreakof necrotizing enterocolitis coincident with an epidemic of neonatal rotavirus gastroenteritis. An Esp Pediatr. 1988; 29(4): 307-310.
- Boccia D, Stolfi I, Lana S, Moro ML. Nosocomial necrotising enterocolitis outbreaks: epidemiology and control measures. Eur J Pediatr. 2001; 160(6): 385-391.
- Hällström M, Vesikari T, Janas M, Ikonen S, Tammela O. Screening of rotavirus and adenovirus infections during prolonged hospitalization in a neonatal unit. Acta Paediatr. 2001; 90(10): 1.196-1.198.
Miositis viral aguda: a propósito de un caso
Señor Director:
La miositis viral aguda es una de las complicaciones posibles de la infección por el virus Influenza y también por otros virus. Constituye una entidad clínica poco reconocida que se presenta como un cuadro muy característico.
Es muy importante llevar a cabo un adecuado reconocimiento clínico para evitar la realización de pruebas diagnósticas y tratamientos innecesarios.
Caso clínico
Varón de 6 años que, en la primavera de 2008, consulta por presentar de forma brusca un cuadro de impotencia funcional en las extremidades inferiores y un dolor que le impide la deambulación, precedido de un cuadro viral de las vías respiratorias altas y fiebre de 3 días de evolución.
En la exploración presenta un dolor intenso a la palpación en la región gemelar y una leve hiperemia faríngea.
El proceso se autolimita en 3 días, tras mantener reposo y tomar antiinflamatorios orales.
En el análisis de sangre aparece leucopenia (2.400 leucocitos/mL) y una notable elevación de las cifras de CPK (27.706 U/L), CPK-Mb (509 U/L), GOT (974 U/L) y GPT (211 U/L).
Las cifras de CPK descienden a los 7 días a valores casi normales (376 U/L), y disminuyen notablemente las concentraciones de GOT (53 U/L) y GPT (121 U/L).
El informe de la serología viral no mostró resultados significativos, aunque dado el contexto epidemiológico en el que se desarrolla el cuadro, la clínica y la posterior evolución, podría tratarse de una infección por adenovirus.
El frotis faríngeo, la proteína C reactiva (PCR), el análisis de heces y el análisis de orina fueron normales.
Discusión
La miositis aguda benigna posviral se presenta generalmente a la edad de 3-7 años. En la mayoría de los casos se asocia a la infección por Influenza B (62%) e Influenza A (25%), aunque también se han descrito asociaciones a Cosackie, Parainfluenza, HSV, CMV, virus de Epstein-Barr, adenovirus, virus de la rubeola, parvovirus B19, arbovirus, retrovirus (VIH), virus de la parotiditis, hepatitis C y Campylobacter.
Constituye un cuadro clínico de dolor muscular intenso en las extremidades inferiores, de aparición brusca, sin antecedentes de ejercicio intenso, traumatismo o historia de alteración muscular familiar, que provoca dificultad para la deambulación manteniendo los pies en flexión plantar, y la flexión dorsal provoca un intenso dolor. Suele ir precedido de un cuadro viral de las vías respiratorias altas, y cuando aparece el dolor muscular el estado general es bueno y no siempre se acompaña de fiebre.
La palpación de la región gemelar suele ser muy dolorosa, pero en la inspección no se observan signos inflamatorios agudos. El tono, la fuerza, la sensibilidad y los reflejos permanecen conservados.
En el análisis de sangre podemos encontrar leucopenia, trombopenia, PCR normal, y una elevación muy significativa de la CPK, la mioglobina y las transaminasas. No se ha descrito mioglobinuria grave en niños.
El examen analítico se puede completar con la serología de los distintos virus, el frotis faríngeo y el análisis de heces (por la posible relación con el enterovirus).
Diversos estudios parecen confirmar que no es necesario efectuar pruebas serológicas virales en el contexto epidemiológico. Se podría diagnosticar con mucha probabilidad mediante una adecuada palpación de la masa muscular de ambos gemelos, que sería muy dolorosa, y con una elevación significativa de las enzimas musculares.
La resolución completa de la sintomatología se produce aproximadamente en 48-72 horas, aunque la normalización de la CPK se constata a los 7 días y la de las transaminasas a los 15-30 días.
El tratamiento es sintomático: reposo, abundante hidratación y antiinflamatorios no esteroideos.
Puede plantearse el diagnóstico diferencial con las miopatías bacterianas e inmunológicas (polimiositis, dermatomiositis), y con causas de ataxia aguda (síndrome de Guillain-Barre en su fase inicial). En caso de sospecharse estas afecciones, se recomienda realizar estudios más complejos, como electromiografía, biopsia muscular o pruebas de imagen.
La incidencia de la miositis viral aguda posiblemente sea mucho mayor de lo detectado, por lo que es importante tenerla en cuenta como primera opción diagnóstica en el cotejo epidemiológico estacional, en que el pediatra de atención primaria tiene un papel muy relevante.
Por tanto, es muy importante llevar a cabo un adecuado reconocimiento clínico para evitar la realización de pruebas diagnósticas y tratamientos innecesarios, caros y potencialmente lesivos.
Bibliografía
Álvarez Cordonés MM, Moreno García MI, Álvarez Aldean J, Obando Santaella I. Miositis aguda postinfluenza en niños. Aten Primaria. 1997; 20(4): 210-211.
Anthony JH, Procopis PG, Onvrier RA. Bening acute childhood myositis. Neurology. 1979; 29(7): 1.068-1.071.
Arias Sevilla I, López Escobar A, Pozuelo Jiménez A, Adrados Razola I. Miositis viral aguda. Medifam. 2002; 12(7): 71-72. Disponible en: http: //scielo.isciii.es/cielo.php?script=sci-arttext&pid= s1131-57682002000700009&lng=pt&nrm=iso
De la Loma A, Ory F, Echevarría J, Tenorio A, Rodríguez M. Miositis agudas infantiles. ¿Una infección viral? Enferm Infecc Microbiol Chile. 1997; 15: 565-566.
García Mozo R, Campuzano Martín S. Miositis aguda en relación con el virus de la gripe. Rev Pediatr Aten Primaria. 2003; 5: 577-581.
McIntyre PG, Dohe C. Acute bening myositis during childhood: report of five cases: Clin Infect Dis. 1995; 20: 722.
Muñoz García M, Valverde Molina J, Díez Lorenzo P, Cámara Simón M. Miositis viral aguda. ¿Es necesaria la confirmación etiológica? An Esp Pediatr. 1998; 48: 333-334.
Gastroenteritis vírica en niños hospitalizados. Estudio prospectivo multicéntrico
Introducción: El objetivo de este estudio fue determinar prospectivamente la etiología vírica de la gastroenteritis aguda (GEA) en lactantes hospitalizados, así como describir las características clínicas de los principales virus.
Pacientes y métodos: Desde octubre de 2006 hasta marzo de 2007, se realizó el seguimiento de todos los niños de 1-23 meses de edad hospitalizados en tres hospitales, desde el momento de la admisión hasta las 72 horas tras el alta, para detectar la presencia de GEA. Se analizó una muestra de heces de los niños con GEA para la detección de rotavirus, calicivirus (norovirus y sapovirus), astrovirus y adenovirus mediante transcripción inversa y reacción en cadena de la polimerasa.
Resultados: De un total de 1.576 pacientes hospitalizados, se pudo realizar el seguimiento de 1.300 (82,5%), que han constituido nuestra cohorte de estudio. Un total de 242 niños tuvieron GEA (un 18,6% de la cohorte), obteniéndose muestra de heces de 217 (89,7%). En 91 casos (42%) se detectaron rotavirus, en 72 norovirus (33,2%), en 7 astrovirus (3,2%) y en 2 adenovirus; no se detectó sapovirus en ningún caso. Trece niños (6%) presentaron infecciones mixtas por dos o más virus, y 32 (14,7%) resultaron negativos para todos los virus analizados. En los casos de GEA por norovirus se observa menor apatía y pérdida de peso que en los casos de rotavirus, pero mayor porcentaje de heces con sangre.
Conclusiones: Los virus son una causa frecuente de GEA en los niños menores de 2 años hospitalizados; el principal virus hallado es el rotavirus, seguido del norovirus. Debido a las escasas diferencias clínicas observadas entre rotavirus y norovirus, es necesaria su determinación analítica para su diferenciación.
Hematuria glomerular asociada a la gripe A H1N1
Sr. Director:
La gripe A, variedad H1N1, ha constituido una nueva epidemia que afectó de manera especial a niños y adolescentes, y de la que aún no conocemos en detalle sus diversas manifestaciones y sus posibles complicaciones1. Comunicamos, por su rareza, el caso de un varón de 12 años de edad que presentó un cuadro clínico de hematuria glomerular autolimitada no descrito o documentado hasta el momento.
El niño carecía de antecedentes patológicos y acudió a la consulta a finales de 2009 debido a una emisión súbita de orina colúrica, sin antecedentes de traumatismo renal. No presentaba fiebre, exantemas, dolor en la fosa renal ni síntomas urinarios en las vías bajas. Cinco días antes fue diagnosticado de amigdalitis y aún seguía tratamiento con amoxicilina-clavulánico. En la exploración se observaron los siguientes parámetros: peso de 66 kg (>p97), talla de 166 cm (>p97), índice de masa corporal de 24 kg/m2, perímetro craneal de 56 cm, presión arterial de 125/62 mmHg; el resto de la exploración general no presentaba datos relevantes. Los estudios complementarios mostraron los siguientes resultados: glucosa 100 mg/dL, BUN 29 mg/dL, creatinina 0,62 mg/dL, colesterol total 125 mg/dL, cLDL 63 mg/dL, cHDL 44 mg/dL, triglicéridos 88 mg/dL, calcio 9,26 mg/dL, fósforo 3,73 mg/dL, magnesio 2,45 mg/dL, proteínas totales 7,86 mg/dL, albúmina 4 g/dL, sodio 142 mEq/L, potasio 4,7 mEq/L, cloro 105 mEq/L, GOT 40 UI/L, GPT 46 UI/L, γ-GT 13 UI/L, FA 208 UI/L, PCR 1,1 mg/L, ASLO 280 UI/mL, factor reumatoide 8 UI/L, IgA 128 mg/dL, C3 123 mg/dL (90-180), C4 29 mg/dL (10-40), CH50 59 UI/mL (normal >24 UI/mL); velocidad de sedimentación globular 6 mm/h; ANA negativos; índice de Quick del 96%. En el test de orina al ingreso (tira reactiva) se detectó una densidad de 1.020, un pH de 5, 25 leucocitos/μL y 250 hematíes/ μL. En el sedimento de orina al ingreso se obtuvieron los siguientes parámetros: 2 leucocitos/campo, intensa hematuria (50% dismórficos), y a las 24 horas de evolución, 5 hematíes/ campo. En la determinación de orina de 24 horas (2.080 mL) se obtuvieron los siguientes resultados: GFR 122 mL/min/1,73 m2, FENA 1,01%, RTP 92%, proteinuria 4,5 mg/m2/h y calciuria 1,7 mg/kg/h. En el frotis faríngeo se detectó una flora mixta bacteriana. La inmunofluorescencia en secreciones orofaríngeas fue positiva para influenza A y H1N1, y negativa para influenza B. La fijación del complemento en suero dio positivo a 1/128 para influenza A, y negativo para influenza B y adenovirus. La determinación de anticuerpos heterófilos, así como la serología IgM para citomegalovirus, toxoplasma, virus de Epstein-Barr y herpes tipos 1 y 2, fueron negativas. El urocultivo también fue negativo. En la ecografía renal se observaban unos riñones de tamaño, situación y ecoestructura normales. El paciente evolucionó sin incidencias. La hematuria macroscópica desapareció en 48 horas, y la microhematuria se negativizó en una semana. El paciente no recibió tratamiento con oseltamivir.
La gripe es una infección vírica respiratoria frecuente en niños1. En una serie de 745 niños con gripe, las complicaciones más habituales fueron las siguientes: neumonía bacteriana (15%), convulsión (7%), insuficiencia respiratoria (4%), miositis (2%), encefalopatía (1%) y bacteriemia (1%)2-4. También se han descrito casos de hepatitis y encefalitis5.
El paciente presentó un cuadro de hematuria macroscópica con hematíes dismórficos, que se resolvió rápida y espontáneamente en el seno de una gripe A H1N1. Por ello, consideramos que esta última pudo ser el agente causal de una glomerulonefritis aguda, aunque leve. La glomerulonefritis suele manifestarse como un síndrome nefrítico agudo, de gravedad variable: la hematuria está presente en el 100% de los casos (macroscópica en el 75-90%), la proteinuria suele ser <500 mg/ dL, la función renal abarca desde la normalidad hasta el fallo renal grave, y la hipertensión arterial se presenta en el 60-80% de casos6,7. Podemos constatar la presencia de la gripe pandémica H1N1 por la coincidencia en el tiempo de inmunofluorescencia positiva para H1N1 en secreciones respiratorias y positividad para la gripe A en suero de la fase aguda. Desde el punto de vista epidemiológico, el paciente ingresó en la semana número 46 de 2009, que fue una de las semanas con una mayor tasa de incidencia de gripe y de la nueva gripe en España8 y en la Comunidad Valenciana, con una elevada incidencia en el grupo de niños de 5-14 años de edad9.
Por lo que se refiere a la asociación entre la gripe y la glomerulonefritis, una serie antigua comunica como complicación la insuficiencia renal aguda con oliguria y hematuria10. En un trabajo realizado en nueve soldados con una enfermedad respiratoria no estreptocócica y glomerulonefritis, algunos individuos presentaron datos serológicos de gripe A y B. Los autores concluyeron que las infecciones respiratorias de las vías altas no estreptocócicas frecuentemente se asociaban con glomerulonefritis, y las alteraciones histológicas y de la función renal pueden tardar unos 2-8 meses en normalizarse11.
Bibliografía
1. Cruz-Cañete M, Moreno-Pérez D, Jurado-Ortiz A, García-Martín F, López-Siles J, Olalla-Martín L. El virus de la gripe en pediatría. Un motivo de hospitalización. Enferm Infecc Microbiol Clin. 2007; 25: 177-183.
2. Coffin SE, Zaoutis TE, Wheeler Rosenquist AB, Heydon K, Herrera G, Bridges CB, et al. Incidence, complications, and risk factors for prolonged stay in children hospitalized with community-acquired influenza. Pediatrics. 2007; 119: 740-748.
3. Peltola V, Ziegler T, Ruuskanen O. Influenza A and B virus infection in children. Clin Infec Dis. 2003; 36: 299-305.
4. Dell KM, Schukman SL. Rhabdomyolisis and acute renal failure in a child with influenza A infection. Pediatr Nephrol. 1997; 11: 363- 365.
5. The epidemiology of influenza in children hospitalized in Canada, 2004-2005, in Immunization Monitoring Program Active (IMPACT) centres. CCDR. 2006; 32: 77-86.
6. Rodríguez-Iturbe B, Gordillo Paniagua G. Glomerulonefritis aguda. En: García Nieto V, Santos Rodríguez F, Rodríguez-Iturbe B, eds. Nefrología pediátrica, 2.ª ed. Madrid: Grupo Aula Médica, 2006.
7. Martín Govantes J. Glomerulonefritis aguda. Pediatr Integral. 2005; 9: 353-360.
8. Anónimo [internet]. Madrid: Ministerio de Sanidad y Política Social [citado el 12 de febrero de 2010]. Disponible en: http://www.msc. es/servCiudadanos/alertas/informesGripeA/home.htm
9. Anónimo [internet]. Generalitat Valenciana. Conselleria de Sanitat. Direcció General de Salut Pública. Àrea d'Epidemiologia [citado el 12 de febrero de 2010]. Disponible en: http://www.sp.san.gva.es/ DgspPortal/docs/semgripc.pdf
10. Jones SR. Potential complications of influenza A infections. Western J Med. 1976; 125: 341-346.
11. Smith MC, Cooke JH, Zimmerman DM, Bird JJ, Feaster BL, Morrison RE, et al. Asymptomatic glomerulonephritis after nonstreptococcal upper respiratory infections. Ann Intern Med. 1979; 91: 697-702.
Faringoamigdalitis aguda por Mycoplasma pneumoniae. ¿Etiología infrecuente o infradiagnosticada?
Sr. Director:
La faringoamigdalitis aguda (FAA) es una de las enfermedades más frecuentes en la infancia, y es motivo de numerosas consultas y gran parte de las prescripciones antibióticas en niños1. El cuadro clínico característico asociado a Mycoplasma pneumoniae es la neumonía atípica, aunque también puede producir infecciones asintomáticas, procesos respiratorios altos y manifestaciones extrarrespiratorias2. La frecuencia y la importancia de este agente como responsable de la FAA han sido muy discutidas. Estudios basados en la determinación de la reacción en cadena de la polimerasa en tiempo real (PCR-RT) le otorgan un papel emergente3, mientras que estudios previos, basados exclusivamente en serologías o cultivos, consideran M. pneumoniae como una causa excepcional de FAA4,5.
Presentamos el caso de un niño de 2 años de edad, sin antecedentes personales de interés, que consulta por la presencia de fiebre de hasta 40,2 ºC, de 5 días de evolución, asociada a odinofagia e hiporexia, sin tos ni rinorrea y sin respuesta al tratamiento con penicilina V. En la exploración presentaba adenopatías submandibulares bilaterales >1 cm, amígdalas hipertróficas e hiperémicas con exudado blanquecino bilateral, e irritabilidad sin signos meníngeos. No se detectaron exantemas ni hepatoesplenomegalia. Presentaba una leucocitosis de 16.300 leucocitos (70,6% neutrófilos) y una proteína C reactiva (PCR) >250 mg/L. El test rápido de estreptococo, adenovirus e Influenza en exudado faríngeo resultó negativo. La radiografía de tórax era normal, así como el análisis sistemático de orina. Se realizó un hemocultivo, un urocultivo y serologías (CMV, EBV, Toxoplasma, VHH6, VHH7, parvovirus B19). Ante los elevados valores de la PCR, la persistencia de la clínica y la ausencia de mejoría con penicilina V, se decidió el ingreso del paciente y administrar tratamiento intravenoso con amoxicilina-ácido clavulánico.
Durante la primera semana de ingreso la exploración no se modificó, persistían picos febriles bifásicos, las analíticas no presentaban cambios y la PCR permanecía persistentemente elevada (>250 mg/L). Los cultivos resultaron estériles, las serologías negativas, la ecografía abdominal normal, y la ecografía de cuello era compatible con una adenitis inespecífica. El resultado de la lectura de Mantoux fue igual a 0 mm. Ante la persistencia de una PCR elevada y dado que en las últimas semanas se habían diagnosticado varios casos de neumonía por M. pneumoniae en nuestro servicio, se inició antibioterapia empírica con azitromicina. La fiebre desapareció a las 24 horas, y la exploración y la analítica se normalizaron. La serología mediante enzimoinmunoanálisis al noveno día de ingreso fue positiva para M. pneumoniae (títulos de IgM >1/64). Un mes después se confirmó la infección, con títulos IgM >1/256. Existen pocos casos publicados de infecciones por M. pneumoniae sin afectación de las vías respiratorias bajas o sintomatología catarral6. La PCR-RT permite realizar un diagnóstico rápido, aunque requiere equipo y personal especializados y es una técnica cara7. Un estudio publicado en 2007 analizó 140 niños diagnosticados de neumonía atípica, de los cuales un 32% presentó PCR-RT positiva, valor que ascendió hasta el 87% en los casos en que la duración de la enfermedad fue mayor (2-7 días).
Los autores concluyen que la PCR-RT podría ayudar a establecer un diagnóstico precoz de las infecciones por M. pneumoniae8.
Esposito et al.9 refieren una prevalencia de FAA por M. pneumoniae del 23,9%, una vez descartada la etiología estreptocócica, y empleando para ello tanto la serología como la PCR-RT. Un estudio reciente concluye que M. pneumoniae debe tenerse en cuenta sobre todo si existe clínica de broncoespasmo2. Algunos estudios previos han mostrado resultados discrepantes. Reed et al.4 encuentran prevalencias muy bajas (2%) en series en que el diagnóstico se realiza exclusivamente mediante serología y/o cultivo, mientras que en el trabajo de McMillan et al.5 los porcentajes fueron superiores (15,8%), pero sin diferencias significativas frente a un grupo control de niños sin FAA, por lo que concluyen que el aislamiento de M. pneumoniae no tiene significado patológico. Sin embargo, otras publicaciones recientes que utilizan conjuntamente PCR-RT y serología sí demuestran la capacidad patógena de M. pneumoniae y encuentran diferencias significativas frente a niños sin FAA2,10.
Clásicamente, M. pneumoniae se ha considerado una causa infrecuente de FAA, o incluso como un colonizador sin relevancia patológica. Sin embargo, las nuevas pruebas diagnósticas demuestran un papel importante de dicho germen. Aunque el fármaco de primera elección en la FAA bacteriana es la penicilina V, es frecuente la prescripción incorrecta de azitromicina1. Se presenta un caso que cursó con fiebre prolongada y que precisó hospitalización y la realización de diversas pruebas complementarias. Es infrecuente el estudio serológico de M. pneumoniae en las FAA con test de estreptococo negativo, y aun realizándolo, la IgM suele ser negativa hasta cumplir la primera semana del cuadro clínico. Por otro lado, ¿qué porcentaje de las FAA tratadas de forma incorrecta con azitromicina y con una evolución favorable podrían corresponder a M. pneumoniae, sobre todo teniendo en cuenta los elevados porcentajes de resistencia frente al estreptococo betahemolítico del grupo A? Creemos probable que no se trate de un caso excepcional, sino infradiagnosticado por las limitaciones de las técnicas microbiológicas disponibles actualmente. Otra limitación es que este microorganismo puede aislarse en la garganta como un patógeno primario, como copatógeno asociado a virus respiratorios o en portadores asintomáticos. La evolución benigna de las infecciones por M. pneumoniae no parece justificar el uso sistemático de técnicas caras, como la PCR-RT. Sin embargo, en casos con una mala evolución clínica, como el aquí presentado, tanto la serología como la PCR-RT pueden ayudar a establecer el diagnóstico.
Creemos que sería interesante realizar más estudios e implementar nuevas técnicas para intentar aclarar el verdadero papel de M. pneumoniae en la etiología de la FAA.
1. Ochoa C, Vilela M, Cueto M, Eiros JM, Inglada L; Grupo Español de Estudio de los Tratamientos Antibióticos. Adecuación del tratamiento de la faringoamigdalitis aguda a la evidencia científica. An Pediatr (Barc). 2003; 59: 31-40.
2. Fernández de Sevilla M, Alayeto J, Fernández Y, Muñoz-Almagro C, Luaces C, García-García JJ. Baja prevalencia de la infección por Mycoplasma pneumoniae en niños con faringoamigdalitis aguda. Enferm Infecc Microbiol Clin. 2009; 27: 403-405.
3. Principi N, Esposito S. Emerging role of Mycoplasma pneumoniae and Chlamydia pneumoniae in paediatric respiratory tract infections. Lancet Infect Dis. 2001; 1: 334-344.
4. Reed BD, Huck W, Lutz LJ, Zazove P. Prevalence of Chlamydia trachomatis and Mycoplasma pneumoniae in children with and without pharyngitis. J Fam Pract. 1988; 26: 387-392.
5. McMillan JA, Sandstrom C, Weiner LB, Forbes BA, Woods M, Howard T, et al. Viral and bacterial organisms associated with acute pharyngitis in a school-aged population. J Pediatr. 1986; 109: 747-752.
6. Dionisio D, Valassina M, Uberti M, Fabbri C, Parri F, Saffi EG. Mycoplasma pneumoniae non-pulmonary infection presenting with pharyngitis, polyarthritis and localized exanthem. Scand J Infect Dis. 2001; 33: 782-783.
7. Álvez F, Sánchez JM. Faringoamigdalitis aguda. Protocolos de Infectología 2009 de la Asociación Española de Pediatría [consultado en noviembre de 2010]. Disponible en: http://www.aeped.es/ documentos/protocolos-infectologia
8. Liu FC, Chen PY, Huang F, Tsai CR, Lee CY, Wang LC. Rapid diagnosis of Mycoplasma pneumoniae infection in children by polymerase chain reaction. J Microbiol Immunol Infect. 2007; 40: 507-512.
9. Esposito S, Cavagna R, Bosis R, Droghetti R, Faelli N, Principi N. Emerging role of Mycoplasma pneumoniae in children with acute pharyngitis. Eur J Clin Microbiol Infect Dis. 2002; 21: 607-610.
10. Esposito S, Blasi F, Bosis S, Droghetti R, Faelli N, Lastrico A, et al. Aetiology of acute pharyngitis: the role of atypical bacteria. J Med Microbiol. 2004; 53: 645-651.















